산소로 알츠하이머 유발 단백질 독성 개선
임미희 KAIST 교수팀, 화학도구 설계 성공
구리-아밀로이드 베타 복합체 응집 막아
알츠하이머 유발하는 단백질 독성 개선
국내 연구진이 산소를 이용해 알츠하이머 유발 단백질 독성을 줄이는 방법을 고안했다. 알츠하이머를 비롯한 다양한 퇴행성 뇌질환 치료제 개발에 도움이 될 전망이다.
한국과학기술원(KAIST·총장 신성철)은 임미희 화학과 교수팀이 알츠하이머 유발에 관여하는 것으로 알려진 '구리-아밀로이드 베타 복합체' 응집과 이로 인한 독성을 개선하는 화학 도구를 설계하는데 성공했다고 3일 밝혔다.
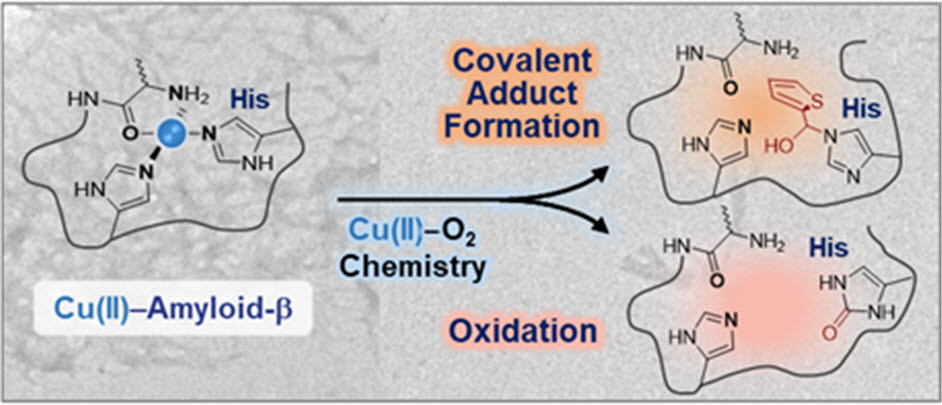
구리-아밀로이드 베타 복합체는 알츠하이머 환자의 노인성 반점에서 고농도로 발견되는 물질이다. 보통 아밀로이드 베타보다 해악 정도가 크다. 아밀로이드 베타와 구리 이온은 강하게 결합하는 성질이 있는데, 이때 응집 현상이 심해지고 활성산소도 과다 생성된다. 이 때문에 구리와 아밀로이드 베타를 표적으로, 이들의 결합을 막는 기법이 주목받고 있다.
연구팀은 알츠하이머 발병 원리에 직간접적으로 관여하는 구리 이온이 공기 중 산소와 반응할 수 있다는 점을 이용했다. 이에 구리-아밀로이드 베타 복합체와 상호작용할 수 있도록 화합물을 합리적으로 설계하고, 해당분자가 산소가 존재하는 환경에서 구리 배위권에 위치한 특정 아미노산에 결합 및 산화에 의한 이중 변형을 일으킨 것을 확인했다.
연구팀이 개발한 배위권 이중 변형 기법을 통해 구리-아밀로이드 베타 응집 과정과 섬유 형성 정도가 확연히 달라지는 것을 확인했다. 또 기존 대비 세포 독성도 줄어든 것을 관찰했다.
연구팀은 이번 연구에서 다양한 변수를 통제, 아밀로이드 베타 구리 배위권 변형 원리를 분자 수준에서 제안한 것에 큰 의의가 있다고 설명했다.
임미희 교수는 “알츠하이머 발병에 관여한다고 알려진 구리 이온이 산소와 반응할 수 있다는 점을 역으로 이용했다”며 “이번 연구에서 최초로 발표한 단백질 내 구리 배위권 이중 변형 기법을 바탕으로 다른 퇴행성 뇌질환 치료제 개발에도 더욱 박차를 가할 수 있을 것”이라고 말했다.
대전=김영준기자 kyj85@etnews.com
'天醫healing > 天醫 산소 테라피' 카테고리의 다른 글
| 다이어트 성공의 비밀, 활성산소에 있다.뇌경색, 뇌졸중 및 각종 뇌질환 치료의 비밀, 활성산소에 있다. (0) | 2022.04.04 |
|---|---|
| 10일만에 암(모든병)치유하기 (0) | 2021.02.17 |
| [생로병사의 비밀] 즐기는 바다에서 치유의 바다로!! (0) | 2020.09.23 |
| 루테인 무엇인가 (0) | 2020.01.22 |
| 자화수의 원리 및 기능 (0) | 2019.08.29 |
| 홍채를 기초로 한 체질 분석 (0) | 2018.06.12 |
| 홍채에 나타난 현상들 (0) | 2018.06.12 |
| [14/12/13 뉴스데스크] 엄마 품의 기적, '캥거루 육아'로 미숙아 생존률 높인다 (0) | 2018.06.08 |
| 암과 칼슘 그리고 뼈 이규헌박사세미나 토론토 캐나다 2017년9월특강...더보기 (0) | 2018.05.29 |
| 잃어버린 자연의 리듬 찾기… 그래서, 반려식물 (0) | 2018.05.26 |